Sono stati recentemente pubblicati sul New England Journal of Medicine i risultati dello studio di Fase 3 volto ad analizzare la sicurezza e l’efficacia del vaccino contro il SARS-CoV-2 prodotto e sviluppato da Johnson & Johnson. Lo stesso si è dimostrato efficace all’85% contro le forme gravi/critiche della malattia, con ampi margini di sicurezza per quanto riguarda la presentazione di eventi avversi. Lo stesso, inoltre, si è dimostrato efficace anche contro le principali varianti virali attualmente in circolazione.
Il vaccino Ad26.COV2.S Johnson & Johnson

Vaccino monodose Johnson & Johnson
Per verificare l’efficacia del vaccino in esame è stato condotto uno studio di efficacia internazionale, randomizzato, in doppio cieco e controllato con placebo. Per far ciò i partecipanti sono stati assegnati in modo casuale in un rapporto 1:1 a ricevere una singola dose di vaccino Ad26.COV2.S o placebo.
Gli outcome primari erano rappresentati dall’efficacia del vaccino contro il Covid-2019 in forma grave che avesse avuto un esordio di almeno 14 giorni e almeno 28 giorni dopo la somministrazione tra i partecipanti nella popolazione che erano risultati negativi al virus. Inoltre, lo studio ha valutato anche la sicurezza del vaccino.
Caratteristiche del campione
Lo studio ha iniziato l’arruolamento il 21 settembre 2020 e la data limite stabilita per la consegna dei dati è stata il 22 gennaio 2021. Un totale di 44.325 partecipanti sono stati sottoposti a randomizzazione, dei quali 43.783 hanno ricevuto vaccino o placebo. La popolazione dunque ha incluso 39.321 partecipanti negativi ai test per il rilievo di SARS-CoV-2, dei quali 19.630 hanno ricevuto Ad26.COV2.S e 19.691 hanno ricevuto placebo. Le caratteristiche demografiche e le condizioni coesistenti dei partecipanti al basale erano bilanciate tra i due gruppi.
Il follow-up mediano è stato di 58 giorni (range da 1 a 124) e il 55% dei partecipanti ha avuto almeno 8 settimane di follow-up; il reclutamento successivo e più lento di partecipanti di età pari o superiore a 60 anni con condizioni coesistenti ha determinato una durata più breve del follow-up in questo sottogruppo.
Risultati
Sicurezza
La sottopopolazione volta all’analisi della sicurezza includeva 3356 partecipanti nel gruppo vaccino e 3380 nel gruppo placebo. Durante il periodo di 7 giorni dopo la somministrazione del vaccino o del placebo, sono stati segnalati più eventi avversi sollecitati dai destinatari di Ad26.COV2.S rispetto ai destinatari del placebo e dai partecipanti di età compresa tra 18 e 59 anni rispetto a quelli di età pari o superiore a 60 anni.
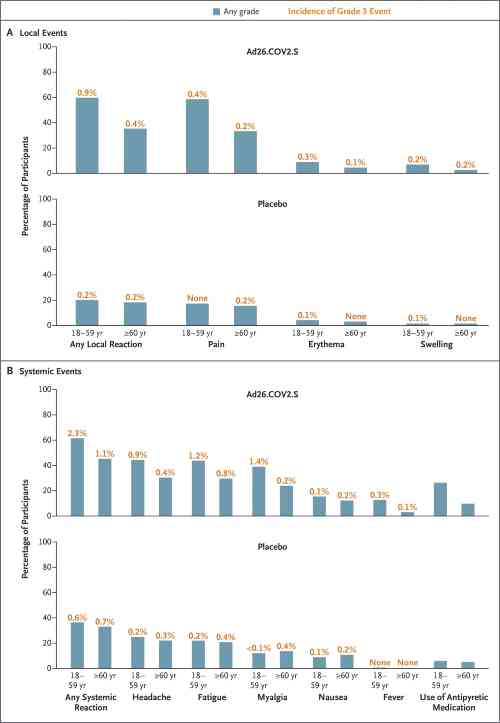
Nel gruppo vaccino, la reazione locale più comune era il dolore nel sito di iniezione (48,6% dei partecipanti), mentre le reazioni sistemiche più comuni sono state cefalea (38,9%), affaticamento (38,2%), mialgia (33,2%) e nausea (14,2%).
Gli eventi avversi gravi, esclusi quelli relativi al Covid-19, sono stati segnalati da 83 su 21.895 destinatari del vaccino (0,4%) e da 96 su 21.888 destinatari del placebo (0,4%). Solamente sette eventi avversi gravi sono stati considerati dai ricercatori come correlati alla vaccinazione nel gruppo Ad26.COV2.S.
Analizzando i dati è stato osservato uno squilibrio numerico per eventi tromboembolici venosi (11 nel gruppo vaccino Vs 3 nel gruppo placebo). Tuttavia, la maggior parte di questi partecipanti presentava condizioni mediche sottostanti e fattori predisponenti che avrebbero potuto contribuire a questi eventi. Sono stati osservati squilibri anche per quanto riguarda le convulsioni (4 partecipanti nel gruppo vaccino Vs 1 nel gruppo placebo) e acufeni (6 Vs 0). Nonostante questi dati, non è possibile determinare con certezza una relazione causale tra questi eventi e Ad26.COV2.S e questi eventi saranno monitorati nel contesto di somministrazione di massa.
In riferimento ai decessi, ne sono stati segnalati tre nel gruppo vaccino e 16 nel gruppo placebo, tutti considerati dagli investigatori come non correlati all’intervento dello studio. Inoltre, nessun decesso correlato a Covid-19 è stato segnalato nel gruppo vaccino, mentre nel gruppo placebo sono stati segnalati 5 decessi correlati al Covid-19. Nel gruppo sottoposto a vaccinazione sono state osservate anche una trombosi del seno trasverso con emorragia cerebrale e un caso di sindrome di Guillain-Barré.
Efficacia
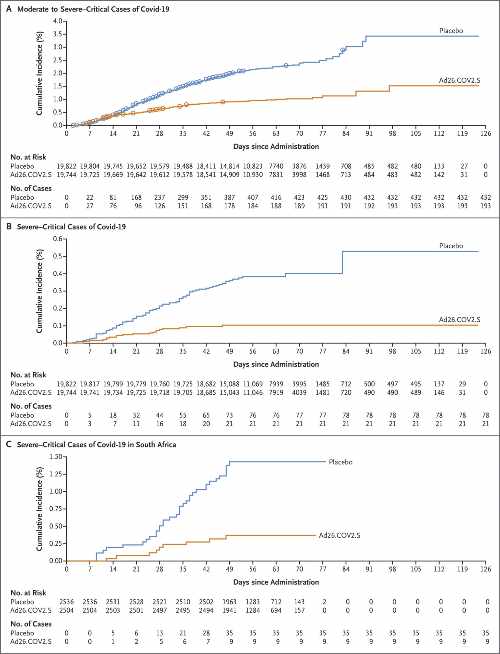
Nel campione preso in esame sono stati osservati 468 casi di Covid-19 sintomatico con insorgenza almeno 14 giorni dopo la somministrazione, di cui 464 da moderati a severi-critici (116 casi nel gruppo vaccino vs 348 nel gruppo placebo), il che indica un’efficacia del vaccino del 66,9% (CI 95%, 59,0 - 73,4).
In termini di endpoint primario di insorgenza della malattia almeno 28 giorni dopo la somministrazione, sono stati osservati 66 casi di Covid-19 da moderato a grave/critico nel gruppo vaccino e 193 casi nel gruppo placebo, che indica un’efficacia del vaccino del 66,1% (IC 95%, 55,0 - 74,8).
L’incidenza cumulativa della presentazione del Covid-19 da moderato a grave diverge tra i due gruppi di studio dopo circa 14 giorni la somministrazione del vaccino o del placebo, il che indica un inizio precoce della protezione con il vaccino. Un minor numero di casi nel gruppo vaccino è stato osservato dopo il giorno 14, mentre i casi hanno continuato ad accumularsi nel gruppo placebo, il che ha portato ad aumentare l’efficacia del vaccino nel tempo.
L’efficacia contro la malattia con insorgenza almeno 28 giorni dopo la somministrazione era simile tra i gruppi di età, ma l’efficacia contro la malattia con insorgenza 14 giorni dopo la somministrazione era più alta tra i partecipanti più anziani che tra i partecipanti più giovani. Questa discrepanza deriva probabilmente dalle differenze nella durata del follow-up o dalle dimensioni del campione più piccole nei sottogruppi.
Per quanto riguarda il Covid-19 grave-critico, l’efficacia del vaccino è stata del 76,7% (IC 95%, 54,6 - 89,1) contro la malattia con insorgenza almeno 14 giorni dopo la somministrazione e dell’85,4% (IC 95%, 54,2 - 96,9) contro la malattia con insorgenza almeno 28 giorni dopo la somministrazione. Le curve di incidenza cumulativa hanno cominciato a separarsi circa 7 giorni dopo la somministrazione. L’efficacia del vaccino è aumentata con un follow-up più lungo ed è stata del 92,4% dopo il giorno 42.
L’analisi dell’efficacia del vaccino Johnson & Johnson contro l’infezione asintomatica ha incluso tutti i partecipanti con un test positivo al giorno 71 (ovvero quelli che erano stati sieronegativi o non avevano risultati disponibili al giorno 29 e che erano sieropositivi al giorno 71). Solamente 2650 partecipanti avevano un risultato del test disponibile al giorno 71 e quindi è stato possibile eseguire solamente un’analisi preliminare. Un totale di 18 infezioni asintomatiche sono state identificate nel gruppo vaccino e 50 nel gruppo placebo (efficacia del vaccino: 65,5%; IC 95%, 39,9 - 81,1).
L’efficacia del vaccino contro Covid-19 che comportava un intervento medico variava dal 75,0 al 100,0%. Si sono verificati 2 casi di Covid-19 con esordio almeno 14 giorni dopo la somministrazione nel gruppo Ad26.COV2.S e 29 nel gruppo placebo che hanno portato al ricovero in ospedale (efficacia del vaccino: 93,1%; IC 95%, 72,7 - 99,2). Nessun ricovero per casi con un esordio almeno 28 giorni dopo la somministrazione si è verificato nel gruppo vaccino, rispetto a 16 ricoveri nel gruppo placebo (efficacia del vaccino: 100%; IC 95%, 74,3 - 100,0).
I partecipanti con Covid-19 moderato che avevano ricevuto Ad26.COV2.S hanno riportato da 4 a 6 sintomi, rispetto ai 7 a 9 sintomi nei partecipanti che avevano ricevuto placebo. Il punteggio medio totale della gravità dei sintomi come riportato nel questionario Sintomi di infezione da Coronavirus-19 era inferiore del 24% (IC 95%, -1 - 46) tra i destinatari del vaccino rispetto ai destinatari del placebo al giorno 1 dopo l’insorgenza dei sintomi, del 47% (IC 95%, 23 - 66) inferiore al giorno 7 dopo l’insorgenza dei sintomi e del 53% (IC 95%, 0 - 81) inferiore al giorno 14 dopo l’insorgenza dei sintomi tra i partecipanti con un esordio di malattia moderata almeno 28 giorni dopo la somministrazione.
Sulla base dei dati di sequenziamento ad interim ottenuti da 512 campioni unici positivi alla RT-PCR derivanti da 714 partecipanti (71,7%) con infezione SARS-CoV-2, la sequenza di riferimento (Wuhan-Hu-1, inclusa la mutazione D614G) è stata rilevata prevalentemente negli Stati Uniti (190 sequenze su 197 [96,4%]) e la variante B.1.351 è stata rilevata prevalentemente in Sud Africa (86 sequenze su 91 [94,5%]), mentre in Brasile, la sequenza di riferimento è stata rilevata in 38 sequenze su 124 (30,6%) e la sequenza di riferimento con la mutazione E484K (lignaggio P.2) è stata rilevata in 86 sequenze su 124 (69,4%).
Nonostante l’elevata prevalenza della variante B.1.351 in Sud Africa e nei casi di Covid-19 nello studio, l’efficacia del vaccino è stata mantenuta (52,0% contro malattia critica da moderata a grave e 73,1% contro malattia grave-critica con esordio ≥ 14 giorni dopo la somministrazione; 64,0% contro malattia critica da moderata a grave e 81,7% contro malattia grave-critica con insorgenza ≥28 giorni dopo la somministrazione). In particolare, in Sud Africa, non si sono verificati ricoveri di partecipanti con un esordio di Covid-19 almeno 28 giorni dopo la somministrazione nel gruppo vaccino, rispetto a 6 ricoveri nel gruppo placebo. Tutti e cinque i decessi avvenuti nello studio in Sud Africa e correlati al Covid-19 si sono verificati nel gruppo placebo.
Una stima puntuale inferiore dell’efficacia del vaccino è stata osservata tra i partecipanti di età pari o superiore a 60 anni con condizioni coesistenti nell’analisi dei casi con esordio almeno 28 giorni dopo la somministrazione (15 casi di Covid-19 da moderato a grave-critico tra i destinatari del vaccino Vs. 26 casi tra i destinatari del placebo) ma non nell’analisi dei casi con esordio almeno 14 giorni dopo la somministrazione (22 Vs 63 casi). Le stime di efficacia nel tempo basate sull’analisi di Kaplan-Meier erano simili tra i partecipanti di età pari o superiore a 60 anni con condizioni coesistenti e quelli senza condizioni coesistenti (Fig. S4C e S8). Due partecipanti di età pari o superiore a 60 anni con condizioni coesistenti nel gruppo vaccino sono stati ricoverati in ospedale, rispetto a 11 di tali partecipanti nel gruppo placebo (efficacia del vaccino, 81,6%; IC 95%, da 15,8 a 98,0).
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?