È stato pubblicato il 10 dicembre sul New England Journal of Medicine uno studio volto ad indagare l’efficacia del Tocilizumab, un farmaco bloccante il recettore dell’interleuchina-6, nei pazienti ospedalizzati con Covid-19. I risultati mostrano come la somministrazione di questo principio attivo non ha abbia avuto effetti significativi sul rischio di intubazione o morte, sul peggioramento della malattia, sul tempo di sospensione dell'ossigeno supplementare o su uno qualsiasi degli esiti di efficacia che ha preso in considerazione.
Tocilizumab, studio sulla sua efficacia nei pazienti Covid-19
Tocilizumab, farmaco bloccante il recettore dell’interleuchina-6
Le evidenze attualmente disponibili in merito alla base fisiopatologica sottostante il Covid-19 suggeriscono che alla base del livello di gravità della malattia vi sia una grave risposta infiammatoria simile alla sindrome da rilascio di citochine. In questa fase, i pazienti mostrano dei livelli di marcatori infiammatori francamente anormali, inclusi livelli sierici elevati di interleuchina-6, ferritina e proteina C reattiva.
Concentrazioni sieriche elevate di interleuchina-6 sono state dimostrate essere associate a livelli più elevati di viremia SARS-CoV-2, eliminazione prolungata dell'RNA virale, progressione verso la ventilazione meccanica e morte.
Questi risultati hanno portato i ricercatori ad ipotizzare che il blocco del recettore dell'interleuchina-6 potrebbe interrompere questa cascata infiammatoria ed evitare il declino clinico del paziente.
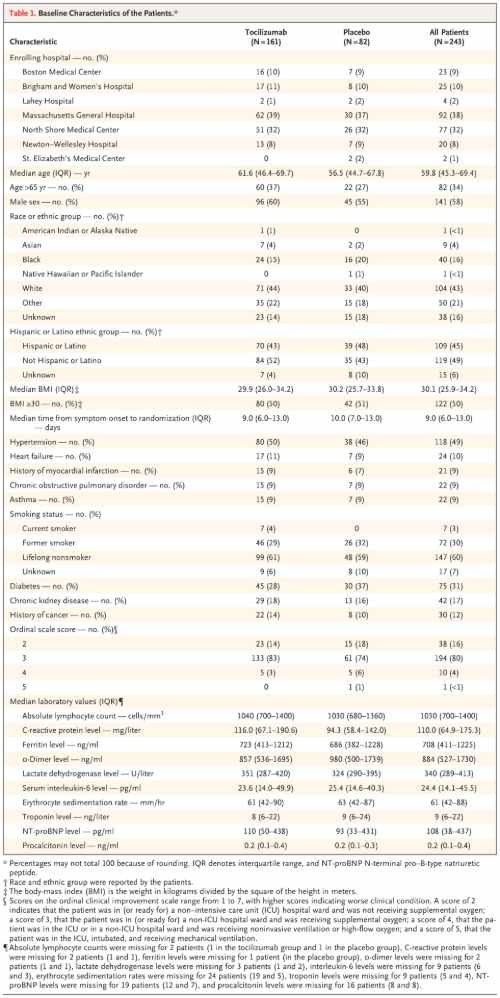
Caratteristiche del campione e disegno di studio
Lo studio è stato condotto in doppio cieco presso sette ospedali di Boston e i pazienti erano eleggibili per l'arruolamento se avevano un'età compresa tra 19 e 85 anni e avevano un'infezione da SARS-CoV-2 confermata tramite tampone nasofaringeo analizzato con metodica RT-PCR o dal test degli anticorpi IgM sierici.
I pazienti, inoltre, dovevano manifestare almeno due dei seguenti segni: febbre > 38°C entro 72 ore dell'arruolamento, presenza di infiltrati polmonari o necessità di ossigeno supplementare per mantenere una saturazione di ossigeno superiore al 92%.
Oltre a questi criteri clinici, doveva essere soddisfatto anche almeno uno dei seguenti criteri laboratoristici: un livello di proteina C reattiva superiore a 50 mg/l, un livello di ferritina superiore a 500 ng/ml, un livello di D-dimero superiore a 1000 ng/ml o un livello di lattato deidrogenasi superiore a 250 U/l.
Per quanto riguarda i criteri di esclusione, i pazienti non erano eleggibili se ricevevano ossigeno supplementare a una velocità superiore a 10 l/min, se avevano una recente storia di trattamento con agenti biologici o terapia immunosoppressiva a piccole molecole, se stavano ricevendo altre terapie immunosoppressive che li avrebbero esposti a un maggior rischio di infezione o se avevano avuto diverticolite.
I pazienti sono stati assegnati in modo casuale in base all’ospedale in cui si trovavano in un rapporto 2:1 a ricevere cure standard più una singola dose di tocilizumab (8 mg/kg per via endovenosa, dose massima 800 mg) o placebo. La randomizzazione è stata stratificata in base al sito.
Outcome
Outcome primario
L'outcome primario era l'intubazione o la morte, qualora i pazienti fossero deceduti prima dell'intubazione, dopo la somministrazione di tocilizumab o placebo.
Questo outcome è stato valutati in relazione al tempo con un follow-up a 28 giorni di distanza.
Outcome secondari
- Peggioramento clinico: è stato definito sulla base di una scala ordinale di miglioramento clinico. I punteggi sulla scala sono stati definiti come segue:
- Dimesso o pronto per la dimissione
- Degente o pronto per essere trasferito presso un reparto ospedaliero non intensivo e non ricevente ossigeno supplementare
- Degente o pronto per essere trasferito in un reparto ospedaliero non intensivo e ricevente ossigeno supplementare
- Degente in terapia intensiva o in un reparto ospedaliero non intensivo ma ricevente ventilazione non invasiva o ossigeno ad alti flussi
- Degente in terapia intensiva intubato e sottoposto a ventilazione meccanica
- Degente in terapia intensiva e ricevente ossigenazione extracorporea o ventilazione meccanica e supporto aggiuntivo per organi
- Deceduto
Il peggioramento clinico è stato definito come un aumento di almeno 1 punto tra i pazienti che avevano ricevuto ossigeno supplementare al basale o di almeno 2 punti tra coloro che non avevano ricevuto ossigeno supplementare al basale.
- Interruzione dell'ossigeno supplementare tra i pazienti che lo avevano ricevuto al basale.
Entrambi questi outcome secondari sono stati valutati in relazione al tempo. I dati dei pazienti che erano liberi da eventi alla fine del follow-up sono stati censiti a 28 giorni per il primo outcome secondario o a 29 giorni per il secondo.
Outcome terziari
Gli outcome terziari erano quelli relativi ad altre analisi temporali, quali:
- Evento: miglioramento, dimissione o morte
- Analisi di durata: somministrazione di ossigeno supplementare o di ventilazione meccanica
- Risultati binari: ricovero in unità di terapia intensiva o morte
Sono state condotte inoltre delle analisi esplorative che hanno affrontato le varie relazioni intercorrenti tra i livelli dei biomarcatori infiammatori, le caratteristiche demografiche e cliniche dei pazienti e gli esiti di efficacia.
Risultati dello studio su Tocilizumab in Covid-19
Outcome primario
Un totale di 27 pazienti (11,2%) sono stati intubati entro 28 giorni o sono morti prima dell'intubazione. Al 28° giorno 17 pazienti (10,6%) nel gruppo tocilizumab e 10 pazienti (12,5%) nel gruppo placebo erano stati intubati o erano deceduti (11 intubati e 6 morti senza essere intubati nel gruppo tocilizumab; rispettivamente 8 e 2 nel gruppo placebo). Nella figura che segue sono riportate le curve di Kaplan-Meier per questo esito.
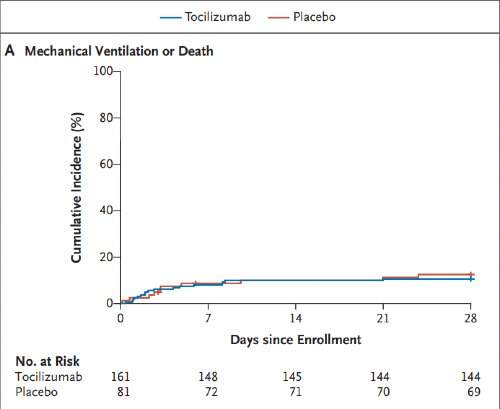
Nel dettaglio, l'hazard ratio per un evento di esito primario nel gruppo tocilizumab è stato di 0,83 (IC 95% 0,38 - 1,81; P = 0,64). Questo valore è stato stimato anche attraverso l’aggiustamento per età, sesso, razza, gruppo etnico ispanico o latino, stato del diabete e concentrazione sierica di interleuchina-6 basale. L'hazard ratio così aggiustato era di 0,66 (IC 95% 0,28-1,52).
La differenza tra gli hazard ratio aggiustati e non aggiustati era principalmente dovuta alla maggiore percentuale di pazienti anziani nel gruppo tocilizumab.
Outcome secondari
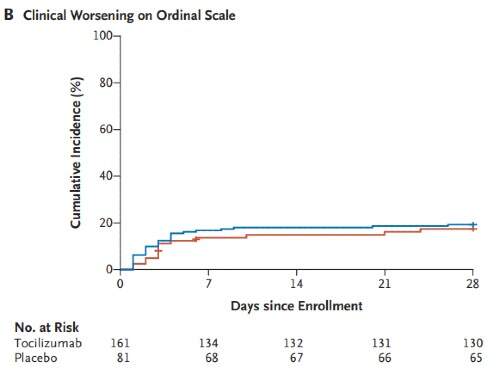
La curva di Kaplan-Meier in riferimento al peggioramento sulla scala ordinale di miglioramento clinico sono mostrate in Figura 2. Nel dettaglio, l'hazard ratio per il peggioramento nel gruppo tocilizumab rispetto al gruppo placebo era 1,11 (IC 95% 0,59-2,10; P = 0,73). L'hazard ratio aggiustato era 0,88 (IC 95% 0,45-1,72).
A distanza di 14 giorni, il 18,0% dei pazienti nel gruppo tocilizumab e il 14,9% dei pazienti nel gruppo placebo aveva avuto un peggioramento clinico della malattia e, a 28 giorni, le percentuali erano rispettivamente del 19,3% e del 17,4%.
La curva di Kaplan-Meier per il tempo per la sospensione dell'ossigeno supplementare tra i pazienti che lo avevano ricevuto al basale sono mostrate nella figura che segue.
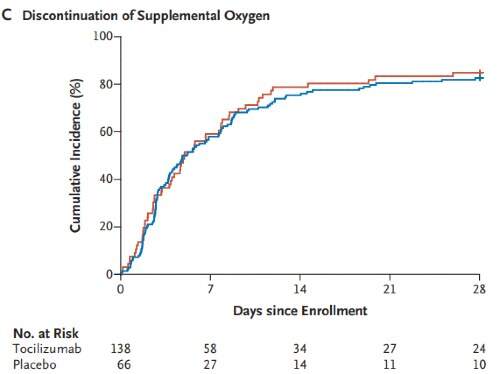
In particolare, l'hazard ratio a 28 giorni nel gruppo tocilizumab rispetto al gruppo placebo è stato di 0,94 (IC 95 % 0,67-1,30; P = 0,69). L'hazard ratio aggiustato era 0,95 (IC 95% 0,67-1,33).
Il tempo mediano richiesto per la sospensione dell'ossigeno supplementare tra i pazienti che lo avevano ricevuto al basale è stato di 5,0 giorni nel gruppo tocilizumab e di 4,9 giorni nel gruppo placebo. A 14 giorni di distanza, il 75,4% dei pazienti nel gruppo tocilizumab e il 78,8% nel gruppo placebo non riceveva più ossigeno supplementare. A 28 giorni, le percentuali erano rispettivamente dell'82,6% e dell'84,9%.
Outcome terziari
Nessuno degli outcome terziari differiva sostanzialmente tra i due gruppi di trattamento:
- Il tempo mediano al miglioramento è stato di 6,0 giorni nel gruppo tocilizumab e di 5,0 giorni nel gruppo placebo
- La durata mediana dell'uso di ossigeno supplementare dopo la somministrazione di tocilizumab è stata di 4,0 giorni e di 3,9 giorni nel gruppo placebo
- Tra i 233 pazienti che non erano in terapia intensiva al momento dell'arruolamento, 25 pazienti (15,9%) nel gruppo tocilizumab e 12 pazienti (15,8%) nel gruppo placebo sono stati ammessi in terapia intensiva o sono morti prima del ricovero in terapia intensiva
- Tra i 19 pazienti che sono stati intubati, la durata della ventilazione meccanica non differiva significativamente tra i gruppi
- Il tempo mediano alla dimissione è stato di 6,0 giorni in entrambi i gruppi
















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?