La valvulopatia cardiaca è una patologia determinata da anomalie strutturali e/o disturbi della funzione valvolare cardiaca. Tale termine è generico, in quanto include un insieme di entità eziologiche, ciascuna caratterizzata da una propria fisiopatologia, presentazione clinica e storia naturale.
Valvulopatie cardiache, cosa sono e come si manifestano
La stenosi tricuspidale
Prima di parlare di valvulopatia cardiaca, conviene dare uno sguardo alle strutture anatomiche.
Le valvole cardiache
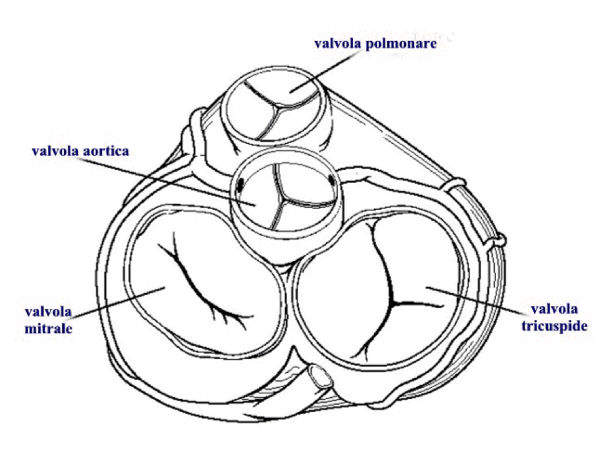
Le valvole cardiache sono delle strutture anatomiche che servono per garantire che il sangue si muova attraverso le camere cardiache in una sola direzione. Per questo motivo, le valvole cardiache sono quattro:
- Tricuspide: è collocata tra l'atrio e il ventricolo destro ed è costituita da tre lembi. Oltre ai lembi, questa valvola è composta da un anello valvolare che congiunge i lembi al cuore e da corde e muscoli papillari che uniscono i lembi valvolari al muscolo cardiaco;
- Mitrale: è localizzata tra l'atrio e il ventricolo sinistro ed è costituita da due lembi. Oltre ai lembi, questa valvola è composta da un anello valvolare che congiunge i lembi al cuore e da corde e muscoli papillari che uniscono i lembi valvolari al muscolo cardiaco;
- Polmonare: è localizzata tra il ventricolo destro e l'arteria polmonare. La valvola polmonare è inserita direttamente sul muscolo della parte più distale del ventricolo destro;
- Aortica: è localizzata alla giunzione tra il ventricolo sinistro e l'aorta ascendente. La valvola ha tre cuspidi e un anello di tessuto su cui si inseriscono le cuspidi.
Durante il ciclo cardiaco, le valvole rivestono un ruolo fondamentale per coordinare e garantire l’unidirezionalità del flusso sanguigno che passa attraverso il cuore.
Durante il periodo di rilassamento ventricolare (diastole ventricolare), i ventricoli si riempiono di sangue, i muscoli papillari sono rilassati e le valvole atrioventricolari (mitrale e tricuspide) aperte non offrono resistenza al flusso sanguigno dall’atrio al ventricolo. Durante questo periodo, le valvole semilunari (polmonare e aortica) sono chiuse; queste non necessitano delle corde tendinee in quanto le posizioni relative delle cuspidi sono stabili, e le tre cuspidi simmetriche si sostengono l’un l’altra come i piedi di un treppiedi.
Quando il ventricolo comincia a contrarsi (sistole ventricolare), il sangue che lascia i ventricoli apre le valvole semilunari, mentre il sangue che refluisce verso gli atri chiude le cuspidi delle valvole atrioventricolari. La tensione dei muscoli papillari e delle corde tendinee permette il mantenimento in sede dei lembi e ne impedisce il ribaltamento all’interno dell’atrio. Ciò impedisce il rigurgito, o reflusso, di sangue nell’atrio, che altrimenti avverrebbe ad ogni sistole ventricolare.
Patologia valvolare
Le patologie che coinvolgono le valvole cardiache conducono ad alterazioni che possono essere restrittive (stenosi valvolare) oppure di incontinenza (insufficienza valvolare). Tali vizi, inoltre, possono essere isolati, combinati oppure composti, ovvero possono coinvolgere più valvole contemporaneamente.
Stenosi mitralica
La stenosi mitralica è più frequente nei pazienti di sesso femminile in quanto ha generalmente un’eziologia reumatica, essendo questa condizione più frequente nel sesso femminile; più raramente è determinata da endocardite infettiva, neoplasie, calcificazione massiva dell’anulus, LES (Lupus Eritematoso Sistemico), mixoma atriale o grosso trombo a palla; queste ultime due condizioni possono determinare stenosi mitralica, in quanto occupando una buona parte dell’atrio sinistro possono in parte occludere l’orefizio valvolare.
Questa patologia è la seconda malattia valvolare in ordine di frequenza e si manifesta in forma isolata nel 45% dei casi ed associata ad altre valvulopatie nel restante 55%.
Per stabilire il grado di stenosi è necessario tenere in considerazione che l’orifizio valvolare mitralico normale ha un’area di 4-6 cm². In base alla riduzione dell’area valvolare si distinguono quattro gradi di stenosi mitralica:
- Lieve: Area 2 - 1.5 cm²
- Moderata: Area 1.5 – 1 cm²
- Severa: Area 1 – 0.6 cm²
- Serrata: Area < 0.5 cm²
Da un punto di vista fisiopatologico, una riduzione dell’orifizio valvolare a valori inferiori a 2,5 cm2 determina un aumento della pressione atriale sinistra. Poiché la pressione ventricolare sinistra rimane normale, si instaura un “gradiente transvalvolare”, il quale dipende dalle dimensioni dell’orifizio valvolare e dal flusso attraverso la valvola, il quale a sua volta è determinato dalla portata cardiaca e dalla durata della diastole. L’ostacolo all’efflusso determina un aumento della pressione in atrio sinistro, che causa dilatazione atriale e che si ripercuote a monte, a livello del circolo polmonare, con aumento di pressione e distensione delle vene e dei capillari polmonari, causando in questo modo un incremento del contenuto idrico del polmone, dapprima intravascolare e poi extravascolare, diminuendo così la compliance del polmone e accrescendo il lavoro respiratorio. Con il tempo il polmone diventa rigido per fibrosi: per questo motivo il principale sintomo è la dispnea, che aumenta con lo sforzo ma può essere presente anche a riposo.
L’attività fisica, determinando un aumento del flusso transvalvolare e, in seguito all’aumento della frequenza cardiaca, la riduzione del riempimento diastolico, causa un marcato aumento della pressione atriale sinistra e capillare polmonare, che si manifesta con la dispnea. La più grave manifestazione della congestione polmonare è l’edema polmonare, che si verifica quando la pressione capillare polmonare supera la pressione oncotica (25-30 mmHg). L’eccessivo e prolungato aumento della pressione polmonare (>70 mmHg) rappresenta un impedimento allo svuotamento del ventricolo destro, la cui ridotta contrattilità determina insufficienza cardiaca destra, con congestione sistemica.
I sintomi in genere non compaiono prima che l’area valvolare sia scesa al di sotto di 1.2 cm2 e sono determinati dalle due variazioni emodinamiche tipiche della valvulopatia: il gradiente atrioventricolare, con aumento della pressione atriale sinistra e polmonare:
- Dispnea (dapprima da sforzo, successivamente anche a riposo);
- Ortopnea;
- Dispnea parossistica notturna;
- Edema polmonare;
- Emottisi;
- Astenia ed affaticamento (dovute alla riduzione della portata cardiaca);
- Palpitazioni ed embolie sistemiche possono essere manifestazioni di fibrillazione atriale, frequente complicanza della stenosi mitralica.
Insufficienza mitralica
Per insufficienza mitralica si intende un insieme di alterazione delle componenti dell’apparato valvolare mitralico (lembi, anello, corde tendinee o muscoli papillari) che determina un’incompleta chiusura della valvola durante la sistole ventricolare, con reflusso di sangue dal ventricolo sinistro all’atrio sinistro.
Da un punto di vista eziologico tale patologia può essere primitiva, per alterazione primitiva dell’apparato valvolare, o secondaria, per disfunzione dell’apparato valvolare, da danno localizzato o da dilatazione della camera ventricolare sinistra. Può essere inoltre dovuta a:
- alterazioni dei lembi valvolari: nei casi di endocardite reumatica, endocardite infettiva, anomalie congenite (difetto dei cuscinetti endocardici), o anomalie del connettivo;
- alterazioni dell’anulus: determinate da calcificazioni idiopatiche o dalla dilatazione del ventricolo sinistro;
- alterazioni dei muscoli papillari (tipo allungamento o rottura): secondari a cardiopatia ischemica, trauma, o mal allineamento; in caso di aneurisma ventricolare sinistro, cardiomiopatia ipertrofica o fibroelastosi endomiocardica;
- alterazioni delle corde tendinee (tipo rottura): può essere idiomatica o da endocardite infettiva (anche reumatica), cardiopatia ischemica, trauma o allungamento (può essere idiomatico o da alterazione del collagene).
Per quanto concerne la fisiopatologia, in condizioni di normalità la chiusura della valvola mitrale è quasi completa ancor prima del periodo della contrazione isometrica. Al momento della sistole ventricolare la circonferenza dell’anello mitralico si riduce e questo consente ai lembi valvolari di collabire. L’anello valvolare scende leggermente nella cavità ventricolare, le pareti del ventricolo si avvicinano, l’accorciamento dei muscoli papillari mantiene in tensione le corde e previene il prolasso dei lembi mitralici in atrio sinistro. L’alterata sovrapposizione dei lembi valvolari mitralici determina, durante la sistole, un rigurgito attraverso l’orifizio. La malattia è definita dall’entità del rigurgito e dai meccanismi di adattamento del ventricolo sinistro. L’entità del rigurgito dipende da area dell’orifizio, durata della sistole e differenza di pressione tra ventricolo ed atrio sinistro.
Essendo la pressione in atrio più bassa che in aorta, il sangue all’inizio della contrazione ventricolare può rigurgitare in atrio, per cui manca la sistole isovolumetrica ed il rigurgito è olosistolico. Si viene a creare in questo modo un sovraccarico di volume per il ventricolo sinistro, che ad ogni diastole deve accogliere, oltre alla quota di sangue proveniente dal circolo polmonare attraverso l’atrio sinistro, anche quella rigurgitata in atrio durante la sistole precedente, con conseguente progressiva dilatazione.
Si distinguono una forma acuta, dovuta di solito a rottura di corde tendinee, disfunzione di un papillare o a perforazione, che si possono verificare in caso di infarto miocardio acuto, endocardite batterica, o complicanze post-operatorie di chirurgia cardiaca, ed una forma cronica, dovuta di solito a malattia reumatica, malattie del collageno, prolasso mitralico, muscolo papillare unico con mitrale a “paracadute” (prolassante in atrio sinistro).
Nelle forme croniche il ventricolo sinistro si adatta al sovraccarico andando incontro a dilatazione, mentre l’atrio sinistro si dilata notevolmente, non determinando ipertensione polmonare. Tuttavia nel tempo il ventricolo sinistro, sottoposto al sovraccarico di volume, può andare incontro ad un deficit contrattile. Inoltre la dilatazione del ventricolo sinistro causa dilatazione dell’anulus mitralico e quindi un ulteriore aumento del rigurgito, con evoluzione verso lo scompenso cardiaco.
In questa forma i sintomi compaiono gradualmente e possono rimanere molto sfumati per diversi anni. Quando si rende manifesta la disfunzione ventricolare sinistra compare dispnea da sforzo. In presenza di disfunzione ventricolare conclamata compare dispnea a riposo, dispnea parossistica notturna, edema polmonare acuto e sintomi di insufficienza congestizia. A causa della dilatazione dell’atrio sinistro può comparire fibrillazione atriale, che influenza negativamente il decorso della patologia.
Nella forma acuta, un rigurgito di sangue massivo e improvviso non consente al cuore di adattarsi, instaurando una pressione elevata in atrio sinistro la quale si ripercuote a livello polmonare, con rapida evoluzione verso l’edema polmonare acuto.
In questa forma i sintomi esordiscono in modo ingravescente e sono dispnea per sforzi di lieve entità, spesso anche a riposo, ridotta tolleranza allo sforzo ed edema polmonare acuto.
Prolasso mitralico
Per prolasso mitralico si intende un’alterazione della valvola mitrale che determina ridondanza dei lembi con prolasso (protrusione oltre il piano atrioventricolare durante la sistole ventricolare) o sbandieramento verso l’atrio sinistro. Possono essere interessati entrambi i lembi valvolari, ma più comunemente quello coinvolto è il lembo posteriore.
Questa patologia è presente in circa 6% della popolazione, più frequentemente nel sesso femminile. La maggior parte dei pazienti sono asintomatici e la diagnosi è spesso occasionale.
Il paziente con prolasso mitralico può presentare un dolore toracico atipico, retrosternale, prolungato e non correlato con l’esercizio fisico; ciò potrebbe essere dovuto a un eccessivo stiramento delle corde tendinee.
Stenosi aortica
Per stenosi aortica si intende una malattia congenita o acquisita delle valvole semilunari aortiche, caratterizzata da ostruzione al flusso di sangue dal ventricolo sinistro all’aorta, con sviluppo di un gradiente pressorio transvalvolare e ipertrofia di tipo concentrico del ventricolo sinistro
Come si evince dalla definizione, si distinguono distinguere due forme di stenosi aortica:
- Congenita: si instaura su una valvola mono-bi o tricuspide, in quanto l’iterazione valvolare determina un flusso turbolento che deteriora i lembi valvolari e determina successivamente fibrosi, rigidità e calcificazione della valvola;
- Acquisita: può essere calcifica-degenerativa, da reumatismo articolare acuto o da artrite reumatoide.
Per stabilire l’entità della stenosi è necessario considerare che l’area valvolare aortica normale è compresa tra 2 e 3 cm2 (varia in relazione alla superficie corporea); si parla di stenosi significativa quando l’area valvolare è inferiore a 1,5 cm2, mentre la stenosi aortica diventa sintomatica allorquando l’ostio valvolare è ristretto ad 1 cm2 o meno.
Per quanto riguarda la fisiopatologia, quando l’orifizio aortico si riduce del 50%, esso genera una resistenza all’eiezione ventricolare e un aumento della pressione intraventricolare sinistra, con sviluppo di un gradiente pressorio tra ventricolo sinistro ed aorta, la cui entità dipende dal grado di stenosi. Il ventricolo sinistro può adeguarsi al sovraccarico pressorio cronico mediante un’ipertrofia concentrica. Il risultato che ne deriva è l’aumento della massa muscolare miocardica, senza dilatazione della cavità ventricolare sinistra. Questo meccanismo di compenso (ipertofia) comporta, però, un marcato aumento del fabbisogno di ossigeno delle fibre muscolari cardiache. Se però la contrattilità ventricolare sinistra si riduce, o se si verifica un critico incremento dell’ostruzione valvolare, si produce una dilatazione ventricolare che causa una disfunzione sistolica del ventricolo sinistro.
Le manifestazioni cliniche vanno correlate all’aumento del consumo di ossigeno miocardico, alla compressione delle arterie coronarie e alla riduzione della compliance del ventricolo con aumento della pressione diastolica ventricolare (in questo caso l’apporto atriale è indispensabile per un buon funzionamento cardiaco).
- Angina pectoris: secondaria alla discrepanza tra l’aumento delle richieste di ossigeno da parte del miocardio ipetrofico e l’ipoperfusione coronarica.
- Sincope: secondaria alla riduzione della perfusione cerebrale che si verifica durante uno sforzo (calo della pressione sistemica per vasodilatazione periferica senza adeguato aumento della portata cardiaca). Può essere determinata anche da aritmie ipercinetiche che possono insorgere durante lo sforzo per l’eccessivo aumento della pressione endoventricolare sinistra. Durante attività fisica infatti si ha un fisiologico incremento della pressione arteriosa sistemica; in presenza di stenosi aortica il ventricolo deve quindi aumentare notevolmente la sua pressione in modo da superare quella aortica e far sì che la valvola aortica si apra.
- Dispnea: compare in uno stadio avanzato, quando vengono meno i meccanismi compensatori e il ventricolo si dilata e la portata cardiaca e la frazione di eiezione si riducono.
- Morte improvvisa: è un’evenienza temibile, da tenere in considerazione soprattutto dopo la comparsa dei sintomi, ma non solamente, poiché a volte può rappresentare l’esordio della patologia. Si verifica più frequentemente durante uno sforzo eccessivo, per ipoafflusso cerebrale o per la comparsa di tachiaritmie ventricolari gravi, scatenate dall’eccessivo aumento della pressione endoventricolare.
Insufficienza aortica
L’insufficienza aortica è caratterizzata da un reflusso diastolico dall’aorta in ventricolo sinistro per lesioni dei lembi valvolari semilunari aortici o dell’aorta ascendente con coinvolgimento dei lembi valvolari. L’insufficienza valvolare si può instaurare progressivamente, dando tempo al ventricolo di compensare il difetto (insufficienza cronica), oppure rapidamente con effetti spesso gravi (insufficienza acuta).
La forma cronica può essere determinata da lesioni valvolari dovute a endocardite reumatica o da malformazioni congenite, quali una valvola bicuspide, un difetto interventricolare o collagenopatie; anche lesioni parietali possono portare all’insufficienza aortica, come nel caso di sifilide, spondilite anchilosante, sindrome di Reiter, sindrome di Marfan, dilatazione idiomatica o ipertensione grave.
La forma acuta può essere determinata da lesioni valvolari, dovute a endocardite infettiva acuta o trauma, o da lesioni parietali, come nel caso di dissezione aortica.
Da un punto di vista fisiopatologico, il ventricolo sinistro ad ogni diastole deve accogliere il sangue che proviene dall’atrio sinistro e quello che torna indietro dall’aorta, causando in questo modo un sovraccarico di volume che è la conseguenza emodinamica di base del difetto. L’entità del sovraccarico dipende dal volume del flusso ematico rigurgitante che può essere determinato dall’area dell’orifizio rigurgitante, dal gradiente pressorio aorta-ventricolo sinistro e dalla durata della diastole.
In questo modo, ad ogni sistole, la gittata è doppia rispetto al normale (quota che rigurgita + quota anterograda); si verifica così un aumento della pressione sistolica arteriosa e una stimolazione dei barocettori carotidei che determina vasodilatazione periferica riflessa. Durante l’esercizio fisico, questa vasodilatazione periferica si accentua ancor di più e consente al ventricolo di aumentare la portata. La riduzione della diastole per aumento della frequenza cardiaca, inoltre, fa sì che durante lo sforzo il rigurgito diminuisca. Ciò spiega l’ottima resistenza all’esercizio fisico di molti pz con insufficienza aortica. Con il tempo, però, la funzione ventricolare comincia a deteriorarsi e si assiste spesso ad un catastrofico peggioramento.
Nell’insufficienza aortica cronica il ventricolo si adatta al sovraccarico di volume con dilatazione e lieve ipertrofia eccentrica; il marcato aumento del volume telediastolico ventricolare mantiene un’adeguata funzione sistolica che nel tempo, progressivamente, si deteriora, arrivando all’insufficienza ventricolare sinistra. Questo tipo di insufficienza aortica può mantenersi asintomatica per anni e la comparsa dei sintomi è indicazione alla correzione chirurgica: astenia, dispnea da sforzo, dispnea parossistica notturna, angina pectoris, edema polmonare acuto.
Nell’insufficienza ortica acuta, invece, manca il tempo per sviluppare la dilatazione e la relativa ipertrofia in risposta all’improvviso sovraccarico di volume, per cui si verifica un aumento cospicuo della pressione telediastolica, ipertensione venosa polmonare ed edema polmonare acuto. Questo tipo di insufficienza aortica si può manifestare con ipotensione, sincope, edema polmonare acuto o shock cardiogeno.
Insufficienza tricuspidale
L’insufficienza tricuspidale è caratterizzata dal rigurgito di sangue dal ventricolo all’atrio destro, con sovraccarico di volume delle due cavità, delle vene cave e dilatazione delle sezioni destre.
Raramente è un vizio isolato, mentre è spesso associato ad un vizio mitralico.
Da un punto di vista eziologico si possono distinguere due tipi sostanzialmente diversi sia per eziologia che per quadro fisiopatologico:
- Secondaria o funzionale: è più comune e origina da una dilatazione del ventricolo destro, quasi sempre secondaria ad una ipertensione polmonare (primitiva o secondaria a valvulopatia mitralica o cuore polmonare cronico). Da un punto di vista fisiopatologico, il quadro che si instaura progressivamente è quello del sovraccarico di volume del ventricolo destro. Questa cavità cardiaca, infatti, ad ogni diastole riceve il sangue refluo venoso, a cui si aggiunge la quantità di sangue rigurgitato in atrio destro durante la sistole precedente. Abitualmente il vizio è ben tollerato e l’evoluzione verso lo scompenso destro è lenta.
- Primitiva o organica: può essere di natura congenita (anomalia di Ebstein) oppure acquisita. Per quanto riguarda la fisiopatologia, il quadro è diverso poiché essa si instaura in presenza di un preesistente sovraccarico ventricolare destro con dilatazione secondaria. In questo caso la comparsa dell’insufficienza fa precipitare i segni di scompenso destro spesso preesistenti.
Nella sua forma cronica, l’insufficienza tricuspidale si manifesta con tensione addominale (da epatomegalia ed ascite), edemi declivi, turgore delle giugulari, dimagrimento, astenia. La forma acuta, invece, è caratterizzata da epatomegalia dolorosa, edemi declivi, turgore delle giugulari, dimagrimento, ed astenia.















Commento (0)
Devi fare il login per lasciare un commento. Non sei iscritto ?